医药网3月21日讯 “哗啦”,国家食药监总局子弹上膛、对准进口药品。
枪响了,一个进口产品应声倒下!这是2017年的第一个,恐怕不会是最后一个。
▍一个进口药品倒下,去年销售8千万
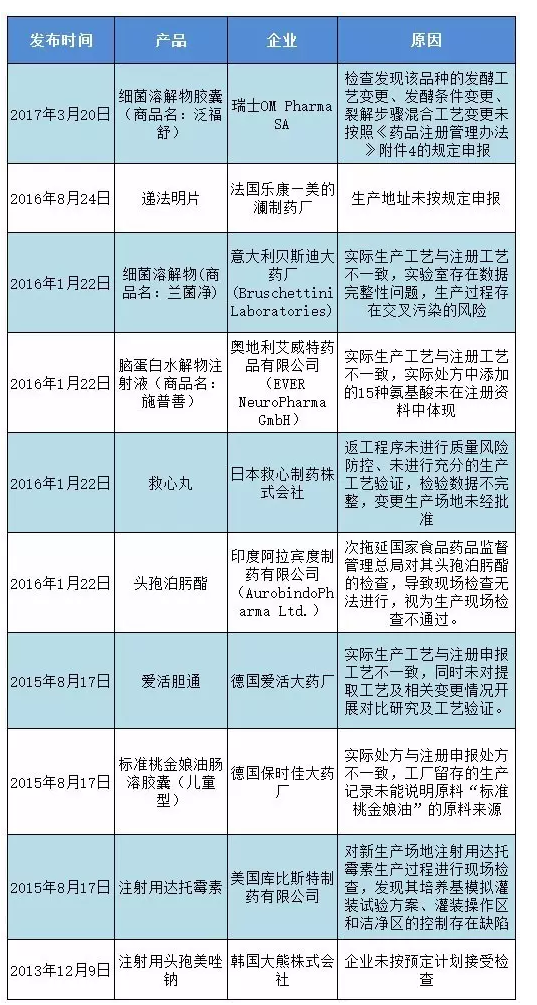
3月20日,总局发布公告,停止进口“泛福舒”。据了解,这个产自瑞士OM Pharma SA的产品,通用名为:细菌溶解物胶囊。用于免疫治疗;可预防呼吸道的反复感染及慢性支气管炎急性发作;可作为急性呼吸道感染治疗的合并用药。
这个产品在2008年前后进入中国,已销售近10年。相关资料显示,“泛福舒”2016年的销售额在8000万元左右,国内没有企业仿制药的申请,国内主要代理公司是设在上海的某外商独资医药分销企业。
总局公告显示,经现场检查发现,该品种的发酵工艺变更、发酵条件变更、裂解步骤混合工艺变更未按照《药品注册管理办法》附件4的规定申报。违反了违反了《中华人民共和国药品管理法》等相关规定。总局决定停止进口“泛福舒”,要求各口岸食药监局停止对其的进口通关备案。
▍10个进口药品被禁,生产工艺是主因
这类产品被禁有“前科”!
在2016年1月22日,总局发布公告禁止进口意大利贝斯迪大药厂的细菌溶解物(商品名:兰菌净)。事实上,这个产品在2016年1月曾被列为境外现场检查的目标。如果在去年“泛福舒”就被查出来问题,想必不会到现在才公布。所以,合理的解释就是:总局对进口产品的境外检查,密度加大了。
在一个重要场合,总局副局长吴浈曾表示:开展境外现场检查实现了中国药品监管关口的前移。从2011年开始,六年来共检查了22个国家的药品生产企业。也的确如此,在总局历年来禁止进口的10个产品中,有6个发生在2016年1月到现在的时间段里。被禁的10个药品,工艺问题比较突出。(详见附件)
▍不过工艺核查这关,就别卖药了
这个产品不让在国内卖了,主要问题就是生产工艺没按规定申报。总局拿着备案的资料现场按图索骥,发现对不上号。
对此,赛柏蓝咨询了药品生产领域的专家,得出的结论是:这个问题也是国内药企的通病,特别是中成药企业。“按照企业备案的生产工艺,大部分产品是生产不出来的”这位专家表示,“原料的含量在变,完全按照备案工艺就亏大了”。
现场工艺核查对药企“杀伤力”很大。在总局近来发布的飞检公告看,其中5家药企被查到的,首当其冲就是生产工艺的问题,以及由此带来的违规添加等等一系列违规。
禁止进口,收GMP证书,今年总局的工艺核查威力尽显。国内、国外药企一视同仁,过不了这一关,药就卖不成了!
附:被禁止进口的药品